中国医学科学院医学生物学研究所研究进展快报第4期 医学生物学研究所鲁帅尧团队揭示基孔肯雅病毒多器官致病新机制,发现潜在干预靶点
2025年1月3日,中国医学科学院医学生物学研究所鲁帅尧团队在MedComm《医学通讯》在线发表了题为“Multi-Organ Proteomic Analysis of Infected Animal Models Predict Potential Host Factors for Chikungunya Virus”的研究论文。研究团队首次系统性地对比分析了基孔肯雅病毒(CHIKV)感染的恒河猴与小鼠模型多器官蛋白组数据,揭示其在天然免疫反应、代谢、炎症反应、组织出血等方面的致病机制,并发现RIG-I、S100A9等潜在关键宿主因子,为新型抗病毒治疗策略提供理论依据。
基孔肯雅病毒是一种由伊蚊传播的流行性病毒,长期以来被认为主要引发关节炎与肌肉痛。然而,近年来临床研究显示其对心脏、肺、肝、脑等多器官也具有严重影响,甚至导致死亡。本研究中,研究团队建立了CHIKV感染的恒河猴和C57BL/6J小鼠模型,系统采集心、肝、脾、肺、肾和脑等器官组织,通过蛋白质组学分析,探索病毒在多器官中的致病机制。研究发现,病毒感染可广泛激活先天免疫通路,特别是一型干扰素相关通路在两种模型的多个器官中显著上调。其中,ROC曲线分析结果显示干扰素刺激因子ISG15在两个物种多器官中具有良好区分感染状态的能力。进一步分析发现,病毒识别受体RIG-I在两种模型中多器官均有显著上调,其下游RLR(RIG-I-like receptor)信号通路的激活提示其可能也在介导宿主抗CHIKV反应中发挥重要作用。研究团队基于分子对接技术筛选出多个RIG-I潜在激动剂,如Inarigivir soproxil及其结构类似物。
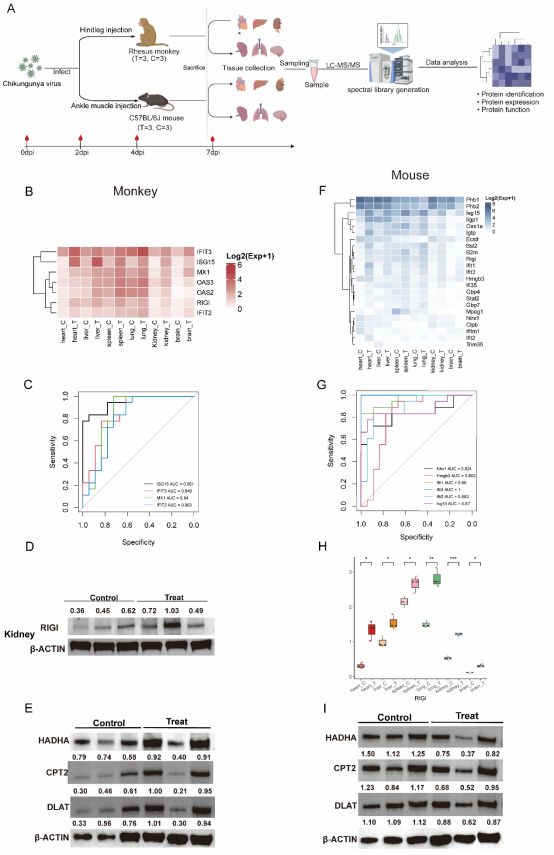
图1. A. 实验流程示意图展示了CHIKV感染动物模型构建、取样及质谱分析的过程。(B, F). 热图展示恒河猴和小鼠多器官共同富集上调天然免疫因子。(C, G) ROC曲线评估了这些基因区分感染状态的诊断效能。(D, H)Western blot验证了RIG-I蛋白在恒河猴肾脏中的表达上调, 箱型图展示了RIG-I蛋白在小鼠多器官中的表达情况。(E, I)Western blotting验证图显示了HADHA、CPT2、DLAT蛋白分别在恒河猴和小鼠感染组与对照组的表达差异。
除了免疫应答,研究还揭示了两种动物模型在代谢反应方面的显著差异。CHIKV感染后,恒河猴普遍上调三羧酸循环、脂肪酸氧化等代谢相关蛋白,而小鼠则表现为整体下调,说明病毒可能通过调控宿主代谢环境实现对感染过程的促进或抑制。在炎症反应方面,研究进一步分析了恒河猴感染后各器官炎症蛋白谱。结果显示,不同器官的炎症反应可能由不同机制驱动,如脾脏和肺部可能以S100A8/A9介导的中性粒细胞炎症为主,而心脏则与线粒体功能障碍相关等。此外,我们在恒河猴感染后的心脏、脾脏和肺组织病理结果在观察到明显的出血性损伤。通过蛋白组与病理结果的相关分析,研究预测了VDAC1/2、ANXA2、KNG1和S100A9等宿主因子可能是介导不同组织出血的关键因子。
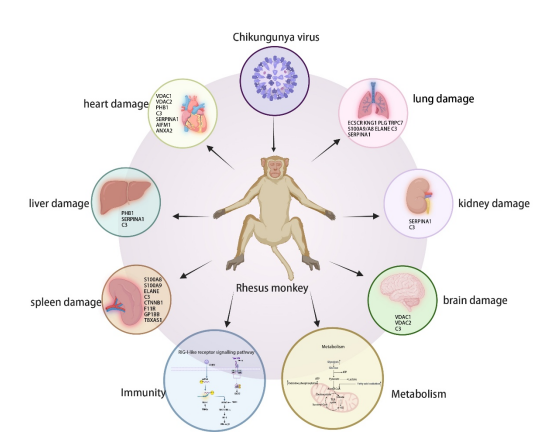
图2 CHIKV感染多器官致病机制图形摘要
本研究工作得到中国医学科学院医学与健康科技创新工程(2021-I2M-1-038、2022-I2M-CoV19-002)、国家重点研发计划(2021YFC230170402)、云南省应用基础研究重点项目(202401AS070049)等项目的资助。医学生物学研究所鲁帅尧研究员为论文通讯作者,林冬冬、唐聪、王俊斌为共同第一作者。
论文链接:https://doi.org/10.1002/mco2.70013

用户登录
还没有账号?
立即注册