2022年生物制品申报与审评情况分析
1、2022年生物制品申报情况
1.1生物制品受理情况
2022年CDE受理生物制品注册申请998个品种(受理号1882个),其中受理生物制品IND申请555个品种(受理号827个),同比增长4.5%;受理生物制品NDA申请91个品种(受理号129个),同比增长8.3%;2018-2022年生物制品注册申请受理情况详见图17。
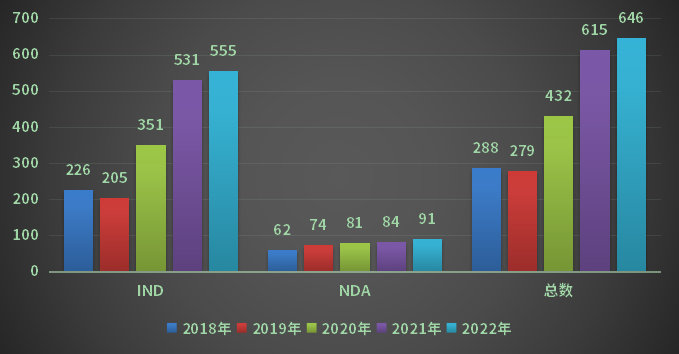
图17 2018-2022年生物制品注册申请受理情况
1.2生物制品创新药申报情况
2022年受理生物制品1类创新药申请452品种(受理号643个),其中国产372个品种(受理号516个,其中预防用生物制品8个,治疗用生物制品508个);进口80个品种(受理号127个,其中预防用生物制品2个,治疗用生物制品125个);以审评任务类别统计,IND申请441个品种(受理号623个),NDA申请13个品种(受理号20个);2022年化药1类创新药注册申请受理情况详见图18。
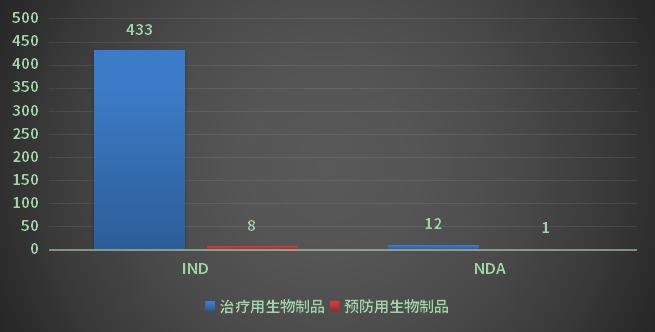
图18 2022年生物制品1类创新药注册申请受理情况
2、2022年生物制品完成审评情况
2.1生物制品完成审评总体情况
2022年CDE完成生物制品审评共1025个品种(受理号1960个);以审评任务类别统计,其中IND申请578个品种(受理号836个),同比增长15.3%,包含预防用生物制品29个,治疗用生物制品549个;NDA申请76个品种(受理号123个),同比减少21.6%,包含预防用生物制品6个,治疗用生物制品70个;2022年生物制品各审评任务类别审结情况详见图19。
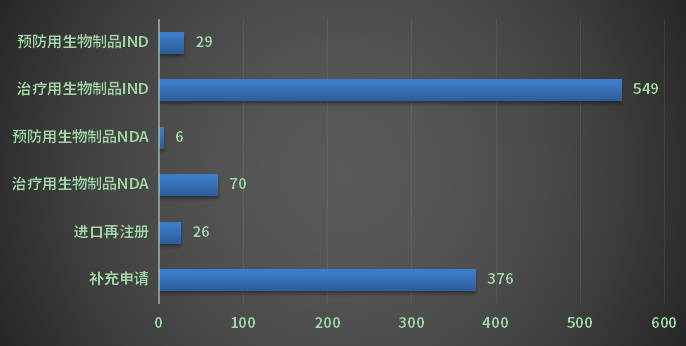
图19 2022年生物制品各审评任务类别审结情况
2.2生物制品创新药批准情况
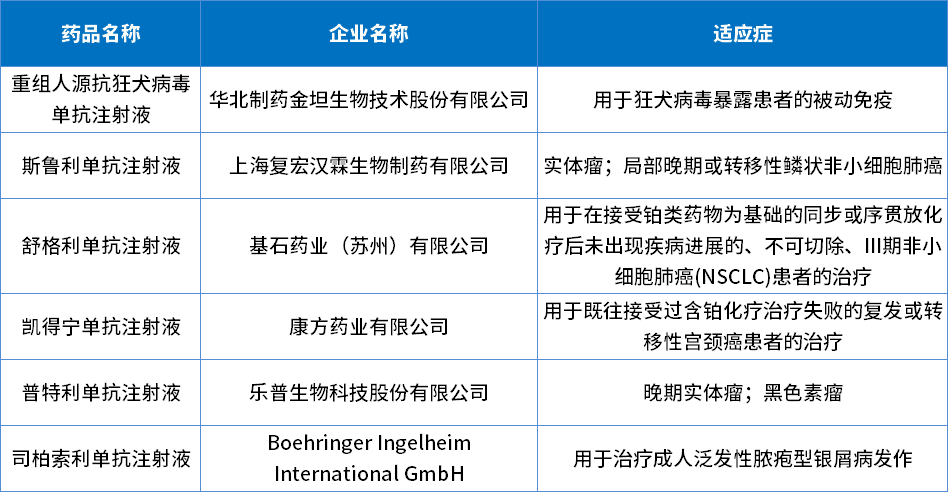
2022年生物制品创新药获批上市有6个品种(新冠药物除外),适应症包含实体瘤、宫颈癌等;2022年批准生物制品创新药详情见表5。
表5 2022年批准生物制品创新药

用户登录
还没有账号?
立即注册