-
2021-06-22
2021-06-22 根据《国家药监局关于实施〈药品注册管理办法〉有关事宜的公告》(2020年第46号),为推进相关配套规范性文件、技术指导原则起草制定工作,在国家药品监督管理局的部署下,药审中心组织制定了《生物制品变更受理审查指南(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审核同意,现予发布,自发布之日起施行。 特此通告。 附件:生物制品变更受理审查指南(试行) 国家药品监督管理局药品审评查看更多 -
2021-06-22
2021-06-22 为推进药品信息化追溯体系建设,指导企业开展药品追溯码具体实施工作,国家药品监督管理局信息中心完成了《药品追溯码印刷规范》《药品追溯码消费者查询结果显示规范》2个标准的征求意见稿(见附件1-2)。现向社会公开征求意见。请填写标准征求意见反馈表(见附件3),于2021年7月20日前以电子邮件形式反馈国家药监局信息中心。 联系电话:010-88331937,88331955 电子邮箱:xxbzc@nmpaic.org.cn 附:1.药品追溯码印刷规范(征求意见稿) 2.药品追溯码消费者查询结果显示规范(征求意见稿) 3.标准征求意见反查看更多 -
2021-06-22
2021-06-22 2020年是极不平凡的一年,面对突如其来的新冠肺炎疫情,国家药品监督管理局药品审评中心(以下简称药审中心)在国家药品监督管理局(以下简称国家药监局)的坚强领导下,认真学习贯彻习近平总书记重要讲话和重要指示批示精神,闻令而动、尽锐出战,坚持人民至上、生命至上,超常规建立“早期介入、持续跟踪、主动服务、研审联动”全天候应急审评审批工作机制,加速推动新冠病毒疫苗和新冠肺炎治疗药物研发上市,充分发挥技术审评对疫情防控的科技支撑作用;主动服务于药监系统工作大局,紧紧围绕落实党中央国务院审评审批制度改革、贯彻《药品管理法》《疫苗管理法》《药品注册管理查看更多 -
2021-06-21
2021-06-21 为配合药品注册管理办法实施,国家药品监督管理局组织制定了《已上市生物制品变更事项及申报资料要求》,现予发布。本通告自发布之日起实施。 特此通告。 附件:已上市生物制品变更事项及申报资料要求 国家药监局 2021年6月17日 国家药品监督管理局2021年第40号通告附件.doc查看更多 -
2021-06-07
2021-06-07 6月1日,2020年新修订的《中华人民共和国专利法》正式施行,在一周前,5月24日,国家知识产权局还发布了《关于施行修改后专利法的相关审查业务处理暂行办法》。 《专利法》及其“配套设施”几乎同步施行,其中与医药行业密切相关的第42条和第76条,即“新药专利权期限补偿制度”和“药品专利链接制度”备受业界瞩目。 01 专利权期限补偿 新专利法的第五章第四十二条首次从立法层面提出了新药专利权期限补偿制度,原文如下: 自发明专利申请日起满四年,且自实质审查请求之日起满三年后授予发明专利权的查看更多 -
2021-05-31
2021-05-31 各省、自治区、直辖市药品监督管理局,新疆生产建设兵团药品监督管理局: 为贯彻《药品管理法》《疫苗管理法》,进一步规范药品检查行为,推动药品监管工作尽快适应新形势,国家药监局组织制定了《药品检查管理办法(试行)》(以下简称《办法》),现予印发。现将有关事宜通知如下: 一、 各省级药品监督管理部门应当按照本《办法》要求,结合本行政区域实际情况,制定实施细则,细化工作要求,组织做好药品生产经营及使用环节检查,持续加强监督管理,切实履行属地监管责任。 二、 各省级药品监督管理部门应当督促本行政区域内药品上市许可持有人等建立和完善药品质量保证查看更多 -
2021-05-31
2021-05-31 中新网5月28日电 国家卫健委网站28日发布《新冠病毒疫苗预防接种不良反应科普知识问答》,具体如下: 一、什么是疑似预防接种异常反应?包括哪些情形? 疑似预防接种异常反应(AdverseEventFollowingImmunization,简称AEFI)是指个体在预防接种后发生的怀疑与预防接种有关的反应或事件。 按照发生的原因,AEFI最终可分为五类,包括不良反应、疫苗质量事故、接种事故、偶合症、心因性反应。 二、什么是疫苗不良反应? 疫苗不良反应是指因疫苗本身特性引起的、与受种者个体差异有关的、且与预防接种目的无关或者意外的反应,包括一般反应和异查看更多 -
2021-05-19
2021-05-19 5月18日晚,CDE发布了关于药品专利纠纷早期解决机制相关专利信息登记平台公开测试等有关事宜的通知,正式上线测试《中国上市药品专利信息登记平台》,这也标志着中国的药品专利链接制度迈出了落地的实质性一步。 2017年10月09日,总局官网转发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》其中明确提出探索建立药品专利链接制度。 为贯彻落实《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》以及《专利法》有关规定,国家药监局会同有关部门积极推进药品专利纠纷早期解决机制实施办法的制定和出台。为配合办法实施,根据国家药监局整体工作部署,经内部讨论和征询查看更多 -
2021-05-18
2021-05-18 2021年5月13日,国家药监局发布《国家药监局关于发布<药物警戒质量管理规范>的公告》(2021年 第65号),吹响了中国医药行业实施GVP规范的号角。 随着2019年修订《药品管理法》的发布和实施,中国法律法规体系的重新构建就逐步展开。针对药物警戒管理方面的工作,这是2019年以后第一次发布的关键文件。 为了帮助各MAH构建和完善符合2021版《药物警戒质量管理规范》的管理体系,笔者建议MAH管理团队从如下八个方面进行考虑和开展工作。 一. 起草和修订药物警戒文件体系需要参考的配套法规 笔者通过整理,到目前为止,和药物警戒工作相关的查看更多 -
2021-05-14
2021-05-14 一、本规范何时实施 国家药品监督管理局于2021年5月7日签发了《药物警戒质量管理规范》(2021年第65号公告,以下简称“规范”),根据规范第一百三十四条,本规范将自2021年12月1日起施行。 二、自规范发布至施行期间持有人和申办者如何开展相关工作 药品上市许可持有人(以下简称“持有人”)和获准开展药物临床试验的药品注册申请人(以下简称“申办者”)应当认真做好规范施行前的准备工作,积极参加相关培训和交流,学习和掌握规范的核心要义及具体内容,着手建立健全药查看更多

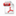



用户登录
还没有账号?
立即注册