-
2021-06-02
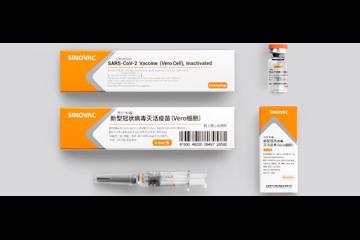
2021-06-02 6月1日,世界卫生组织宣布,由中国北京科兴中维生物技术有限公司研发的新冠灭活疫苗CoronaVac正式通过世卫组织紧急使用认证(emergency use listing),成为了第二个获得该授权的中国国产疫苗。 来源:科兴官网 世卫组织总干事谭德塞当天在记者会上宣布,科兴新冠疫苗被证明是“安全、有效和有质量保证的”,已被列入世卫组织紧急使用清单。此外,该疫苗易于储存的特点使其非常适用于资源匮乏的环境。 根据世卫组织免疫战略咨询专家组的意见,世卫组织建议科兴疫苗用于18岁及以上成年人,采用两剂接种、间隔时间为2至4周查看更多 -
2021-05-31
2021-05-31 5月29日,沃森生物发布公告称,公司于近日收到国家药品监督管理局批准的重组新型冠状病毒疫苗(黑猩猩腺病毒载体)《药物临床试验批件》,该疫苗由公司联合清华大学、天津医科大学共同合作申请。 审批结论:为应对新型冠状病毒感染的肺炎疫情,根据《中华人民共和国药品管理法》、《中华人民共和国疫苗管理法》、《药品注册管理办法》和《国家食品药品监督管理局药品特别审批程序》,经特别专家组评议审核,应急批准本品进行临床试验,适应症为预防由SARS-CoV-2感染而引起的新型冠状病毒病(COVID-19)。 目前全球已有5个基于腺病毒载体技术路线的新型冠状病毒疫苗获查看更多 -
2021-05-28
2021-05-28 当地时间5月27日,葛兰素史克(GSK)宣布,已启动与赛诺菲(SNF)合作研发的佐剂重组COVID-19候选疫苗的3期临床试验,预计将在美国、亚洲、非洲和拉丁美洲等多地区入组35,000多名成人志愿者。 10天前,GSK刚刚公布这款COVID-19候选疫苗的2期临床研究数据,评估了两剂疫苗在722名18岁及以上年龄的健康志愿者中的免疫原性。结果显示,完成第二剂疫苗接种后志愿者体内血清转化率为95%-100%,并且完成单剂疫苗注射后,曾感染过SARS-CoV-2的受试者体内也产生了高水平的中和抗体,说明该疫苗具有作为一款加强疫苗(booster vaccine)的强查看更多 -
2021-05-27
2021-05-27 导读:截至目前,受试者已经入组,并完成第一剂量组给药。 5月25日,前沿生物公告,公司与中国科学院上海药物研究所达成合作,公司获得新冠肺炎病毒(SARS-CoV-2)候选新药FB2001(DC系列候选药物)在全球范围内的临床开发、生产、制造及商业化权利。目前,FB2001已获得美国FDA核准签发的临床试验批件,并在美国启动了FB2001的I期临床试验,采用单中心、随机、盲法、对照设计,主要目的为评价本品在人体的耐受性、安全性和药代动力学特征。 FB2001 候选药物中,DC402234 是基于冠状病毒主蛋白酶三维结查看更多 -
2021-05-27
2021-05-27 导读:这是全球首个正式发表的新冠灭活疫苗Ⅲ期临床试验结果,这也是中国新冠疫苗Ⅲ期临床试验结果的首次发表。 5月26日,国际医学期刊《美国医学会杂志》(The Journal of the American Medical Association, JAMA,IF45.54)刊登了国药集团中国生物发表的《两种新型冠状病毒灭活疫苗对成人COVID-19感染的保护效力评价》(“ Effect of 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adul查看更多 -
2021-05-26
2021-05-26 2021年5月25日,Moderna宣布其mRNA新冠疫苗(mRNA-1273)在青少年(12-17岁)中的2/3期临床研究已达到其主要免疫原性终点,表现出不亚于成人接种组的高度保护效力。本次研究中,接种过2剂该疫苗的青少年未出现新冠病毒感染,与疫苗效力为100%相一致。这款疫苗安全性与耐受性良好,所有接种者将在第二次接种后接受为期12个月的监测,以持续评估这款疫苗提供长期免疫保护的能力与安全性。Moderna计划在6月初将试验数据提交给美国FDA和全球的监管机构。 这项随机双盲、含安慰剂对照的2/3期TeenCOVE临床试验共入组3732年龄在12岁到17岁间的查看更多 -
2021-05-24
2021-05-24 日前,默沙东(Merck&Co. Inc)宣布旗下研究性15价肺炎球菌结合疫苗V114在两项3期儿科临床试验中达到了免疫原性和安全性的主要终点。 在针对年龄在42至90天健康婴儿的首次互换性研究中,接受四剂系列PCV13疫苗的患者,以及接受PCV13混合剂量方案后再接种V114患者的免疫应答结果显示,针对13种血清型或肺炎球菌疾病菌株,施打两种疫苗的效果具有可比性。 在追加研究中,默沙东表示,使用V114用于此前未接种过肺炎球菌疫苗,或者以前曾接受过部分或全部PCV治疗方案的、年龄在7个月至17岁健康儿童的追加施打疫苗方案时,V114对于13种共有的血清型查看更多 -
2021-05-24
2021-05-24 近日,康希诺生物宣布获得匈牙利国家药品与营养研究院(HungarianNational Institute of Pharmacy and Nutrition, OGYÉI)颁发的重组新型冠状病毒疫苗(5型腺病毒载体)(Ad5-nCoV)欧盟GMP证书,成为国内创新疫苗技术路线首个在欧盟获得GMP认证的新冠疫苗生产企业。 来源:康希诺生物 这意味着康希诺生物已经具备了符合欧盟标准的商业化生产基地和质量管理体系,为公司产品进军国际市场奠定了坚实的基础。 1月13日,匈牙利国家药品与营养研究院对康希诺生物进行了GMP审查,判定康希查看更多 -
2021-05-19
2021-05-19 18日,信达生物制药集团和美国礼来制药集团共同对外公布,其联合开发的创新生物药“PD-1单克隆抗体达伯舒”,上市申请被美国食品药品监督管理局(FDA)受理并进入正式审评阶段。 达伯舒(通用名“信迪利单抗注射液”)属于PD-1免疫抗癌药,由信达生物进行早期开发,2015年与美国礼来达成授权合作协议、双方共同开发。在中国新药创制重大科技专项的支持下,达伯舒实现了我国在免疫治疗领域自主研发创新药物的重大突破,成为第一个登上国际学术学术期刊《柳叶刀·血液学》封面的中国PD-1单抗。2018年12月,达伯舒在中国查看更多 -
2021-05-18
2021-05-18 2021年5月17日,赛诺菲(Sanofi)和葛兰素史克(GSK)联合宣布,其联合研发的基于重组蛋白的新冠候选疫苗(含佐剂),在共入组722名志愿者的2期临床试验中获得积极结果。在所有成人年龄组中均获得了较强的中和抗体应答,中和抗体水平与COVID-19康复患者水平相当。该疫苗的全球关键性3期临床试验预计将在未来几周开始。 虽然目前已经有多款新冠疫苗获得批准在世界各地使用,然而在很多中低收入国家,对疫苗的需求仍然没有得到满足。不断出现的新冠突变病毒也意味着新冠疫苗可能也需要持续更新,以提高对新出现的突变病毒的防护能力。赛诺菲和GSK合作开发的候选新冠疫苗是基于查看更多





用户登录
还没有账号?
立即注册