-
2021-04-01
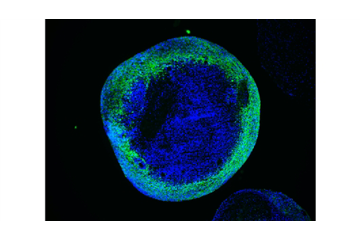
2021-04-01 在莱氏症候群患者的大脑类器官中,神经元不能正常成熟。 图片来源:Agnieszka Rybak-Wolf 莱氏症候群是儿童中最严重的线粒体疾病。它会导致严重的肌肉无力、运动缺陷和智力残疾,通常会导致儿童早夭,目前尚无治疗方法。科学家已经知道,患者基因SURF1通常会发生突变,后者对一种参与细胞能量生成过程的蛋白质进行编码。基于此,研究人员创造了这种罕见疾病的首个人体模型。相关论文近日刊登于《自然—通讯》。 德国杜塞尔多夫大学医院教授Alessandro Prigione团队及合作者,采用了细胞重编程技术,能够将皮肤细胞转化为产生神经元的干细查看更多 -
2021-04-01
2021-04-01 近日接受中新社记者专访时,中国科学院微生物研究所研究员戴连攀指出,新冠重组亚单位蛋白疫苗的一大特点就是更加精准,“让抗体能够精准地识别病毒最核心的一部分”。 由中国科学院微生物研究所与合作企业共同研发的重组新型冠状病毒疫苗(CHO细胞),3月10日获批在中国国内紧急使用。这是中国国内第四款获准紧急使用的新冠病毒疫苗,也是国际上首个获批临床使用的新冠病毒重组亚单位蛋白疫苗。 2020年疫情发生以来,在中科院院士、中国疾病预防控制中心主任高福的带领下,包括该研究所研究员严景华、戴连攀等在内的科技攻关团队设计出针对β冠状病毒感染性疾查看更多 -
2021-04-01
2021-04-01 英国《自然》杂志30日在线发表的一项免疫学研究显示,从南非第一波新冠疫情康复者体内提取的抗体对南非流行的新变种(501Y.V2)中和效果较差;相反,南非第二波疫情中感染501Y.V2变种病毒的6名康复者的血浆可有效中和第一波疫情中的病毒株。这些发现表明,基于新冠病毒新变种的“变种疫苗”,或可有效对抗其他正在流行的新冠病毒种类。 目前出现的令人担忧的新冠病毒新变种,似乎让这些病毒比其他毒株更具传播“优势”。近期,诺瓦瓦克斯(Novavax)、强生和阿斯利康等公司在南非进行的疫苗试验结果显示,501Y.V2变种的流行或令查看更多 -
2021-04-01
2021-04-01 3月30日,世界卫生组织发布中国—世卫组织新冠病毒溯源联合研究报告。 今年1月14日至2月10日,17名中方专家和17名外方专家组成联合专家组,分为流行病学、分子溯源、动物与环境三个小组,在武汉开展了为期28天的全球溯源研究中国部分工作。根据当日发布的联合研究报告,联合专家组评估了关于病毒引入人类的四个路径,认为新冠病毒“比较可能至非常可能”经中间宿主传人,“可能至比较可能”直接传人,“可能”通过冷链食品传人,“极不可能”通过实验室传人。报告提出了联合专家组查看更多 -
2021-04-01
2021-04-01 山东省药品监督管理局: 你局《关于对新〈药品管理法〉中原料药认定问题的请示》(鲁药监字〔2019〕48号)收悉。经研究,现函复如下: 一、关于原料药 全国人大宪法和法律委员会在关于《中华人民共和国药品管理法(修订草案)》审议结果的报告中指出,修订草案按照各方都认可的药品分类,将药品定义中的药品种类进行概括式列举。原料药仍按照药品管理,应当遵守《药品管理法》的规定。 二、关于新修订《药品管理法》第一百二十四条的适用 新修订《药品管理法》主要按照药品的功效,重新界定假药、劣药,并将原《药品管理法》“按照假药论处”&ld查看更多 -
2021-04-01
2021-04-01 国家市场监督管理总局令 第28号 《药品生产监督管理办法》已于2020年1月15日经国家市场监督管理总局2020年第1次局务会议审议通过,现予公布,自2020年7月1日起施行。 局长 肖亚庆 2020年1月22日 药品生产监督管理办法 (2020年1月22日国家市场监督管理总局令第28号公布) 第一章 总 则 第一条 为加强药品生产监督管理,规范药品生产活动,根据《中华人民共和国药品管理法》(以下简称《药品管理法》)、《中华人民共和国中医药法》、《中华人民共和国疫苗管理法》(以下简称《疫苗管理法》)、《中查看更多 -
2021-04-01
2021-04-01 国家市场监督管理总局令 第33号 《生物制品批签发管理办法》已于2020年11月19日经国家市场监督管理总局2020年第11次局务会议审议通过,现予公布,自2021年3月1日起施行。 局长 张工 2020年12月11日 生物制品批签发管理办法 (2020年12月11日国家市场监督管理总局令第33号公布) 第一章 总 则 第一条 为了加强生物制品监督管理,规范生物制品批签发行为,保证生物制品安全、有效,根据《中华人民共和国药品管理法》(以下简称《药品管理法》)、《中华人民共和国疫苗管理法》(以下简称查看更多 -
2021-04-01
2021-04-01 目 录 第一章 总 则 第二章 疫苗研制和注册 第三章 疫苗生产和批签发 第四章 疫苗流通 第五章 预防接种 第六章 异常反应监测和处理 第七章 疫苗上市后管理 第八章 保障措施 第九章 监督管理 第十章 法律责任 第十一章 附 则 第一章 总 则 第一条 为了加强疫苗管理,保证疫苗质量和供应,规范预防接种,促进疫苗行业发展,保障公众健康,维护公共卫生安全,制定本法。 第二条 在中华人民共和国境内从事疫苗研制、生产、流通和预防接种及其监督管理活动,适用本法。本法未作规定查看更多 -
2021-04-01
2021-04-01 (1984年9月20日第六届全国人民代表大会常务委员会第七次会议通过 2001年2月28日第九届全国人民代表大会常务委员会第二十次会议第一次修订 根据2013年12月28日第十二届全国人民代表大会常务委员会第六次会议《关于修改〈中华人民共和国海洋环境保护法〉等七部法律的决定》第一次修正 根据2015年4月24日第十二届全国人民代表大会常务委员会第十四次会议《关于修改〈中华人民共和国药品管理法〉的决定》第二次修正 2019年8月26日第十三届全国人民代表大会常务委员会第十二次会议第二次修订) 目 录 第一章 总 则 第二章 药品研制和注册 第三查看更多

用户登录
还没有账号?
立即注册